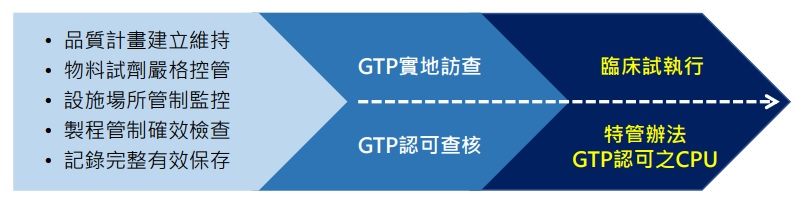
人體細胞組織優良操作規範(Good Tissue Practice, GTP)對於細胞產品之製造方法、設施、
人員及管制措施皆有詳盡的規範,以避免細胞產品遭受汙染,效用及完整性被影響,甚至造成傳染病的傳播與擴散。
換句話說,GTP規範的不僅硬體設施,而是透過完整的品質系統、提供組織來源的檢驗與篩檢、
操作環境與設備的管制與監控、物料試劑的控管、產品製程的管制及檢查….等來確保細胞產品
的品質與安全
艾默生醫於2010年起即提供細胞產品製程開發與製造服務(CDMO), 並於2019年12月取得衛福部「細胞製備場所符合人體細胞組織優良操作規範(GTP)」之三年認可。
艾默生醫設有多個高規格無塵潔淨室,可提供產學研各界進行臨床細胞治療製程開發使用,協助接軌研發與臨床之應用。
- 潔淨度ISO CLASS 7更衣室
- 潔淨度ISO CLASS 7細胞操作培養室
- ISO CLASS 5無菌操作台(BSC)
- HVAC除塵加濕恆溫空調系統
- 高效濾網(HEPA)空氣濾淨
- 無塵室壓差設計符合GMP標準
- 各室出入口氣密門及互鎖設計
- 自動滅菌CO2培養箱
- 潔淨室溫濕壓差監控
- 潔淨室即時影像監控
- 冰箱溫度監控
- 培養箱溫度、CO2監控
- 超低溫冷凍櫃監控
- 液態氮儲存槽監控
- 異常自動警報通知
- UPS不斷電系統
- 定期儀器設備環境消毒
- BSC及環境定期落菌監控
- 單一時段僅操作同來源細胞
- 門禁及監視系統
- 出入紀錄完整並妥善保存
- 出入人員需訓練考核
- 定期分析監控紀錄

